trộn 500 ml dung dịch chứa hỗn hợp HCl 0,1M và H2SO4 0,1M với v ml chứa Ba(OH)2 0,1M . Phản ứng vừa đủ , trung hòa . Tính V , nồng độ mol của các ion trong dung dịch sau phản ứng , khối lượng chất rắn thu được .

Những câu hỏi liên quan
trộn 100 ml dung dịch chứa đồng thời HCl 0,2M và H2SO4 0,1M với 100 ml dung dịch KOH 0,1M và Ba(OH)2 0,1M .
a) tính nồng độ mol của các ion trong dung dịch sau phản ứng .
b) tính pH của dung dịch .
c) tính khối lượng chất rắn thu được thu được sau phản ứng .
nH+=0,04 mol nOH-=0,03 mol
H+ + OH- --------> H20
0,04 0,03
0,03 0,03 0,03
0,01
a/ [H+] du=0,01/0,2=0,05 M
[SO42-]=0,01/0,2=0,05 M
[K+]=0,01/0,2=0,05 M
[Ba2+]=0,01/0,2=0,05M
b/ nH+ du=0,01/0,2=0,05 M
pH=-log(0,05)=1,3
c/ khoi luong chat ran thu duoc sau phan ung la
mcr= mSO42- + mK+ + mBa2+
=0,01.96+0,01.39+0,01.137
=2,72g
Đúng 0
Bình luận (0)
ta có : \(\Sigma n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(n_{SO_4^{2-}}=0,01\left(mol\right)\) ; \(n_{Ba^{2+}}=0,01\left(mol\right)\)
a, PT : \(H^++OH^-\rightarrow H_2O\)
0,03 0,03 0,03 (mol)
\(\Rightarrow n_{H^+}dư=0,01\left(mol\right)\)
đến đây tự tính đc nha. dùng ct \(CM=\dfrac{n}{V}\)
b, \(PH=-log[H^+]=-log\left(\dfrac{0,01}{0,2}\right)\simeq1,3\)
c, \(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
0,01 0,01 0,01 (mol)\(mcr=m\downarrow+m_{K^+}=m_{BaSO_4}+m_{K+}=\left(0,01\times233\right)+\left(0,01\times39\right)=2,72\left(g\right)\)
Đúng 0
Bình luận (0)
trộn 100 ml dung dịch chứa đồng thời HCl 0,2M và H2SO4 0,1M với 100 ml dung dịch KOH 0,1M và Ba(OH)2 0,1M .
a) tính nồng độ mol của các ion trong dung dịch sau phản ứng .
b) tính pH của dung dịch .
a) trong 100 ml dung dịch HCl và H2SO4
CM[H+]=[Cl-]=0,02 M
[SO4 2-]=0,01M
[H+] =2.0,01=0,02 M
trong 100ml dung dịch KOH và Ba(OH)2
[K+]=[OH-]=0,01M
[Ba2+]=0,01M
[OH-]=0,02M
b)n(H+)=0,02+0,02=0,04mol
n(OH-)=0,01+0,02=0,03mol
khi trộn : H+ + OH- =>H2O
0,03<--0,03
=> nH+ dư=0,01mol
=> [H+]=0,05M
=> pH=-lg(0,05)=1,3
Đúng 0
Bình luận (1)
Cho 60mL dung dịch HCl 0,1M tác dụng vừa đủ với V mL dung dịch Ba( OH)2 0,2M
a/ Viết PTHH
b/ Tính giá trị của V
c/ Tính nồng độ mol của dung dịch sau phản ứng
a, \(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
b, \(n_{HCl}=0,06.0,1=0,006\left(mol\right)\)
Theo PT: \(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCl}=0,003\left(mol\right)\)
\(\Rightarrow V_{Ba\left(OH\right)_2}=\dfrac{0,003}{0,2}=0,015\left(l\right)=15\left(ml\right)\)
c, \(n_{BaCl_2}=\dfrac{1}{2}n_{Ba\left(OH\right)_2}=0,003\left(mol\right)\Rightarrow C_{M_{BaCl_2}}=\dfrac{0,003}{0,06+0,015}=0,04\left(M\right)\)
Đúng 2
Bình luận (0)
\(a/2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\\ b/n_{HCl}=0,06.0,1=0,006mol\\ n_{Ba\left(OH\right)_2}=n_{BaCl_2}=0,006:2=0,003mol\\ V_{Ba\left(OH\right)_2}=\dfrac{0,003}{0,2}=0,015l\\ c/C_{M_{BaCl_2}}=\dfrac{0,003}{0,06+0,015}=0,04M\)
Đúng 1
Bình luận (1)
Hòa tan hết 12,060 gam hỗn hợp gồm Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1,0M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau: Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH) 2 0,1M vào dung dịch X, thu được kết tủa lớn nhất. Lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là A. 41,940 B. 37,860 C. 48,152 D. 53,125
Đọc tiếp
Hòa tan hết 12,060 gam hỗn hợp gồm Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1,0M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:

Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH) 2 0,1M vào dung dịch X, thu được kết tủa lớn nhất. Lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là
A. 41,940
B. 37,860
C. 48,152
D. 53,125
Hòa tan hết 12,060 gam hỗn hợp gồm Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1,0M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau: Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH) 2 0,1M vào dung dịch X, thu được kết tủa lớn nhất. Lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là A. 41,940 B. 37,860 C. 48,152 D. 53,125
Đọc tiếp
Hòa tan hết 12,060 gam hỗn hợp gồm Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1,0M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
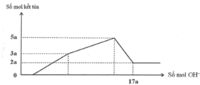
Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH) 2 0,1M vào dung dịch X, thu được kết tủa lớn nhất. Lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là
A. 41,940
B. 37,860
C. 48,152
D. 53,125
Hòa tan hết 12,06 gam hỗn hợp Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau: Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam chất rắn khan. Giá trị của m là A. 48,152. B. 53,124. C. 41,940. D. 37,860.
Đọc tiếp
Hòa tan hết 12,06 gam hỗn hợp Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
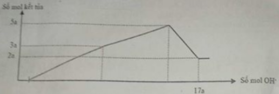
Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam chất rắn khan. Giá trị của m là
A. 48,152.
B. 53,124.
C. 41,940.
D. 37,860.
Đáp án C
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
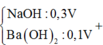


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam
Đúng 0
Bình luận (0)
Hòa tan hết 12,06 gam hỗn hợp Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau: Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam chất rắn khan. Giá trị của m là A. 48,152 B. 53,124 C. 41,940 D. 37,860
Đọc tiếp
Hòa tan hết 12,06 gam hỗn hợp Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
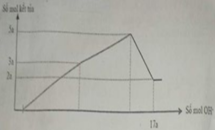
Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam chất rắn khan. Giá trị của m là
A. 48,152
B. 53,124
C. 41,940
D. 37,860
Cho 200 ml dung dịch HCl 0,1M tác dụng vừa đủ với dung dịch Ca(OH)2 0,2M
a) Tính nồng độ mol của dung dịch Ca(OH)2 cần dùng cho phản ứng
b) Tính khối lượng muối tạo thành sau phản ứng
\(n_{HCl}=0,1.0,2=0,02\left(mol\right)\)
Pt : \(2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+2H_2O\)
0,02---->0,01---------->0,01
a) Nồng độ mol đề cho rồi mà nhỉ
b) \(m_{muôi}=m_{CaCl2}=0,01.111=1,11\left(g\right)\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 500ml dung dịch chứa hỗn hợp NaOH 0,3M và Ba(OH)2 0,1M thu được dung dịch Y và 3,36 lít H2 (đktc). Cho dung dịch Y phản ứng với 500 ml dung dịch Z chứa HCl 0,64M và H2SO4 0,08M thu được 21,02 gam kết tủa. Nếu cho dung dịch Y phản ứng với V lít dung dịch Z thì thu được kết tủa lớn nhất có khối lượng a gam. Giá trị của a là: A. 20,750 B. 21,425 C. 31,150 D. 21,800
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 500ml dung dịch chứa hỗn hợp NaOH 0,3M và Ba(OH)2 0,1M thu được dung dịch Y và 3,36 lít H2 (đktc). Cho dung dịch Y phản ứng với 500 ml dung dịch Z chứa HCl 0,64M và H2SO4 0,08M thu được 21,02 gam kết tủa. Nếu cho dung dịch Y phản ứng với V lít dung dịch Z thì thu được kết tủa lớn nhất có khối lượng a gam. Giá trị của a là:
A. 20,750
B. 21,425
C. 31,150
D. 21,800
Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam
Đúng 0
Bình luận (0)



















